含有连续两个手性中心的叔醇结构广泛存在于生物活性分子中。有机金属试剂对α-手性酮的非对映选择性亲核加成是合成该结构普遍的方法,然而其具有明显的局限性:(1) α-手性酮合成困难,且反应过程中可能消旋;(2) 反应的非对映选择性较难预测;(3) 采用化学计量的格氏试剂等金属试剂,反应条件苛刻,官能团兼容性差等。因此,通过动态动力学不对称加成简单易得的消旋酮是合成α,β-手性叔醇更为理想的方法。
通过动态动力学拆分(DKR)过程,从消旋原料一步构建含有连续两个手性中心的手性产物,具有高效、通用、原子经济性等优点。DKR过程的进行需要满足:(1) 消旋原料的两种对映异构体能够进行快速消旋化;(2) 消旋原料的其中一种构型异构体与手性配体生成产物的速率远大于另一种构型;(3) 消旋原料的两种对映异构体相互转化的速率远大于生成产物的速率。酮的不对称氢化反应只能构建手性仲醇结构。采用碳亲核试剂与酮的不对称碳碳成键反应用于构建连续手性中心的手性叔醇结构,但金属催化的酮亲电试剂多集中于能够促进DKR过程的α-酮酯类型的活泼底物,报道的亲核试剂类型也较少。
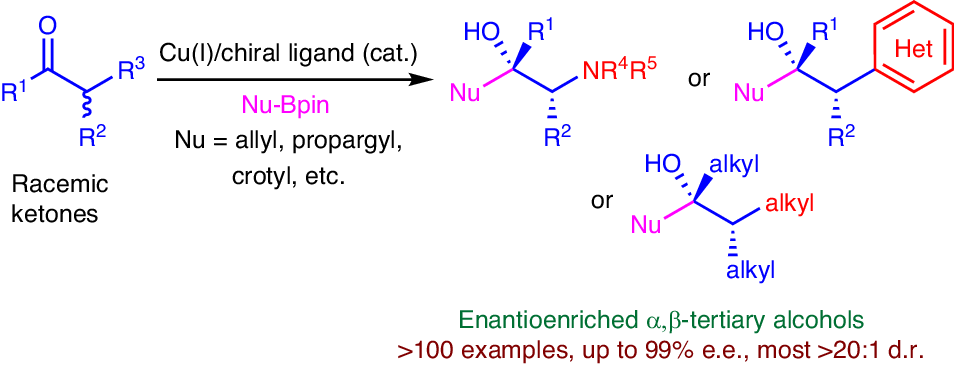
羰基的烯丙基化和炔丙基化是有机合成中应用最广泛的碳碳成键反应之一,产物中的烯烃和炔烃官能团易于进行众多重要的转化。不对称烯丙基化和炔丙基化是构建手性叔醇非常高效的方法。烯丙基或炔丙基有机金属对α-手性酮的非对映选择性亲核加成是构建α,β-手性叔醇结构最直接的方法,但该方法的非对映选择性较难控制。因此,发展高效和高立体选择性的消旋酮的烯丙基化、炔丙基化和丁烯基化反应构建含有连续多个手性中心叔醇结构的方法是化学合成领域的重要挑战性研究前沿。
近日,上海有机所施世良团队联合青岛科技大学孙博团队,采用一价铜/手性膦配体催化体系,实现了消旋酮(α-氨基/芳基/烷基)的高效和高立体选择性的烯丙基化、炔丙基化和丁烯基化反应,一步构建含有连续多个手性中心的手性叔醇结构。产物中烯烃和炔烃的快速转化,促进了手性叔醇结构的多样化。该反应具有优秀的底物范围(>100个例子)和立体选择性(up to >20:1 dr, 99% ee),官能团兼容性好。
相关工作以题为“Dynamic Kinetic Asymmetric Allylation, Propargylation and Crotylation of Ketones using Copper Catalysis”的研究性论文发表在Nature大子刊Nat. Synth.上(Nat. Synth. 2024, DOI: 10.1038/s44160-024-00567-9)。青岛科技大学孙博为本文的第一作者,并且与上海有机所施世良为本文的共同通讯作者。
美国杜克大学Steven J. Malcolmson教授受邀在“News & Views”专栏撰写题为“Shattering the mirror with copper catalysis”的亮点文章(Nat. Synth. 2024, DOI: 10.1038/s44160-024-00589-3),推介了孙博/施世良在动态动力学不对称酮的烯丙基化、炔丙基化和丁烯基化反应研究领域所取得的最新进展。